Update Research: 2021年4月16日NEJM
確定患者之疫苗誘發的血栓形成和血小板減少症(即疫苗誘發的免疫性血栓形成性血小板減少症或VITT)診斷分式。在轉診醫院沒有發現遺傳性或後天性血栓形成的證據。總共鑑定出23名患者進行測試,進行血小板因子4(PF4)抗體的檢測。沒有接觸肝素。
ELISA Test
在英國的六個實驗室通過ELISA進行了抗PF4抗體的測試。在許多情況下,通過化學發光HemosIL AcuStar HIT IgG測定法(Werfen )進行的HIT檢測為陰性,但通過ELISA進行的檢測為陽性。
ELISA包括Lifecodes PF4 IgG分析(Immucor )和Asserachrom HPIA IgG分析(Stago )。
這些測定對於健康對照而言,抗PF4抗體的正常範圍(中值加標準差),對於接受肝素的患者而言,其範圍為正常值。
陽性閾值基於正常範圍(Asserachrom HPIA IgG測定的≤0.238光密度單位[OD],Lifecodes PF4 IgG測定的<0.40 OD)
在對照患者和研究對像中進行功能性HIT分析的結果的Flow Cytometric Analysis (流式細胞術分析)。
在某些情況下,可根據製造商的說明,在參考實驗室中通過功能性HIT分析(HITAlert ,Diapharma )進行ELISA結果的確認。簡而言之,從志願者捐贈者的血液樣本中製備富含血小板的血漿與O組血。將富含血小板的血漿在五個裝有以下物質的試管中孵育:
鈣離子載體,
肝素(每毫升0.3 U),
患者血清,
患者血清加肝素(每毫升0.3 U)及
患者血清加過量肝素(每毫升100 U)。先前從確診為HIT的患者中檢測出的血清樣本用作陽性對照。
根據製造商的建議應用了超過8%的血小板活化陽性閾值 ,用於確認HIT的診斷時,靈敏度為78%,特異性為98%。 使用流式細胞儀(CytoFlex ,Beckman Coulter)分析數據。
血清學和抗體測試 使用了一種多重電化學發光測定法(Meso Scale Discovery)來測量抗SARS-CoV-2抗原的抗體的血清值,包括刺突蛋白,受體結合域(RBD)和核衣殼蛋白。抑制血管緊張素轉換酶2(ACE2)受體蛋白與SARS-CoV-2的刺突蛋白和RBD相互作用的功能性抗體的基本值;季節性冠狀病毒HCoV-OC43,HCoV-HKU1,HCoV-HL63和HCoV-229E的刺突蛋白的抗體值。
結果
在這項研究的23名患者中,中位年齡為46歲(21至77歲),其中16歲(70%)的患者年齡小於50歲。十四名患者(61%)是女性。通過轉診醫院,所有患者均報告為先前健康狀況良好,沒有病史或使用藥物可能導致血栓形成的病史,但有1名有深靜脈血栓病史的患者,和1名已知有深靜脈血栓病史的患者除外。服用聯合口服避孕藥。所有患者均在就診前6至24天 (中位數為12天)接受了第一劑ChAdOx1 nCoV-19疫苗 。在某些患者中明顯出現輕度瘀青和瘀斑。在一些腦靜脈血栓形成的患者中發現了繼發性腦出血。1例未出現血栓形成的患者俱有臨床上明顯的瘀傷,但無其他出血表現。
研究中的23位患者的臨床和實驗室特徵。
在22例出現血栓形成的患者中,
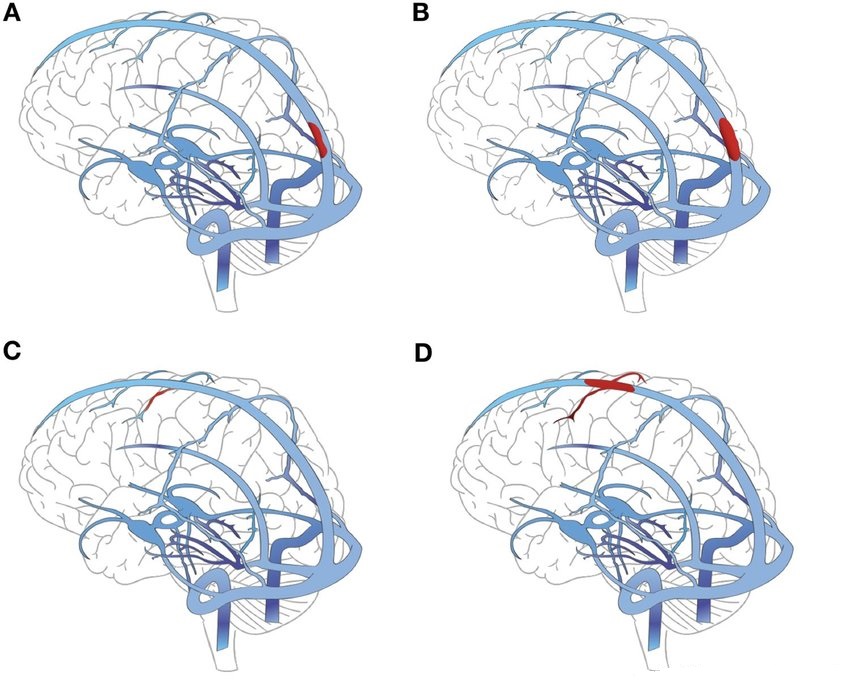
13例的臨床特徵與腦靜脈血栓形成一致(1例並發急性門靜脈血栓和肺栓塞),
4例發生了肺栓塞( 1例同時伴有深靜脈血栓形成),
1例伴有深靜脈血栓形成和雙側腎上腺出血,
2例缺血性中風影響了大腦中動脈區域,
2例伴有門靜脈血栓形成(1例並發急性心肌梗死和1例同時並發急性心肌梗死影像上的主動脈血栓形成)。
在就診時接受血小板輸注或基於肝素的治療的患者中發生了與進展相關的其他血栓形成事件。在整個研究,有7名患者(30%)死亡。一項針對一名患者的事後評估結果顯示,發現許多小血管,特別是肺部和腸道,腦靜脈和靜脈竇的血管中有血栓形成,以及廣泛的腦出血的證據。
實驗室檢驗: 所有患者在出現時SARS-CoV-2聚合酶鏈反應試驗均為陰性(數據未顯示)。
10名可用於檢測的樣本患者的抗核衣殼蛋白抗體的SARS-CoV-2血清學檢測陰性,這一發現排除了最近接觸SARS-CoV-2的可能性。
在所有10例患者中,SARS-CoV-2的刺突蛋白和RBD的抗體水平值均在接受一劑ChAdOx1 nCoV-19疫苗的接受者的範圍內,而季節性冠狀病毒的抗體水平在19例的範圍內。ChAdOx1 nCoV-19疫苗的接種者和普通人群。抑制ACE2-受體蛋白與刺突蛋白和SARS-CoV-2的RBD相互作用的功能性抗體的水平也在接受一劑ChAdOx1 nCoV-19疫苗的接受者的範圍之內。
按照克勞斯的方法(method of Clauss)測定,有13名患者的纖維蛋白原水平較低(範圍為每升0.3至4.5 g;正常範圍為1.5至4.0)。d-二聚體水平(d-Dimer)遠高於急性靜脈血栓栓塞患者的預期水平(中位數為31,301纖維蛋白原當量單位[FEU];範圍為5000至80,000)。
沒有其他相關的實驗室檢測呈陽性,包括血栓形成,抗核抗體,可提取的核抗原和抗磷脂抗體的檢測(數據未顯示)。在可獲得結果的10例患者中,有5例狼瘡抗凝劑檢測為陽性,但在嚴重凝血病和抗心磷脂抗體和抗β2-糖蛋白1b抗體陰性的情況下,這些結果被認為是不可靠的。
在所有23例患者中,抗PF4抗體的ELISA是在給予基於肝素的治療之前獲得的樣品上進行的。儘管用HemosIL AcuStar HIT IgG分析進行的HIT測試在所有接受測試的9例患者中均為陰性,但23例患者中有22例抗PF4抗體的ELISA呈陽性。 一名患者在接種疫苗後10天出現腦靜脈血栓形成,血小板減少症和高d-二聚體值,並且在臨床上無法與其餘同類患者區分開-ELISA(Lifecodes PF4 IgG分析)和功能性HIT分析均為陰性。但是,在患者接受幾次血小板輸注後,呈示後5天獲得了測試樣品。另一名患者-接種後12天出現深靜脈血栓形成和雙側腎上腺出血,但d-二聚體值高,纖維蛋白原值低,沒有其他診斷依據,但ELISA的結果不明確(在Asserachrom HPIA IgG分析中的0.156 OD )。
進行功能性HIT分析以確認ELISA結果在7位接受測試的患者中有5位陽性。這些發現證實了血小板活化的存在與HIT患者相似 ,這是通過在沒有肝素的情況下向患者血清中添加供體血小板來測量的。加入生理劑量的肝素並沒有增加這種作用,但是加入過量的肝素卻完全抑制了這種作用。
討論
針對SARS-CoV-2的疫苗的快速批准和隨後的全球推廣不可避免地導致在收到疫苗後產生不良事件的報告。迄今為止報導的大多數不良事件都與普通人群的背景風險值相似,因此並未引起人們的關注。但是,對於使用複雜診斷方法發現是一種非常罕見的事件,背景風險值可能難以測量或解釋。
這篇報告提到,出現急性非典型血栓形成(主要累及腦靜脈和並發血小板減少症)的大多數年輕,檢測到與肝素治療無關的抗 PF4 抗體 。所有患者出現時的d-二聚體值均比急性靜脈血栓栓塞症患者的預期水平值高得多,通常在癌症患者中才會觀察到。
文中使用的非常保守的d-二聚體Cut-off value為4000 FEU,選擇該選項以確保不會遺漏病例,並考慮對其進行進一步檢查,以免可能會漏掉該綜合症狀的嚴重程度。在所有患者中,均在第一劑 ChAdOx1 nCoV-19 疫苗接種後6 至24 天出現症狀。
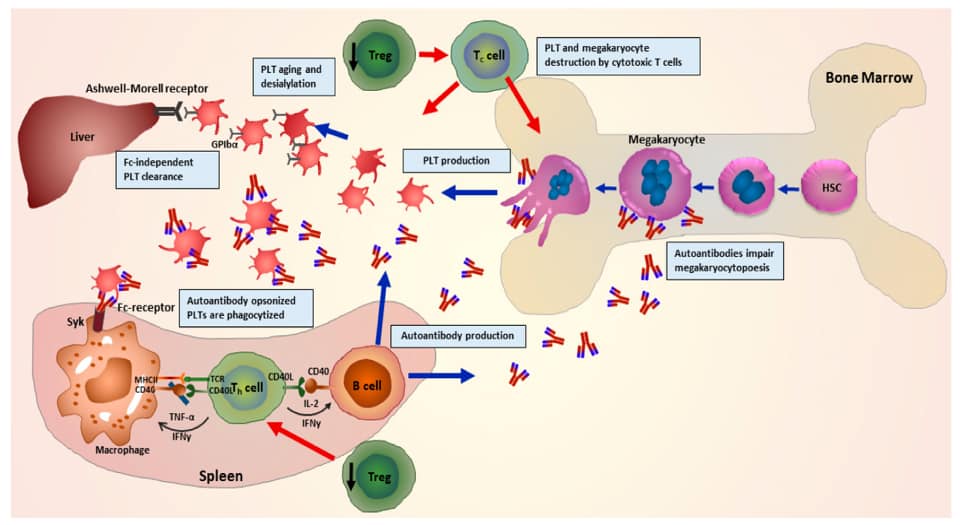
HIT是一種進行性血栓形成疾病,通常會在暴露於肝素後5到14天引起靜脈和動脈血栓形成。它在女性患者中更常見,尤其是在心臟外科手術期間接受普通肝素的患者,以及在術後尤其是心臟和骨科手術中接受肝素的患者。抗PF4抗體的存在證實了診斷。
目前描述與肝素治療無關的病理性抗PF4抗體的罕見檢測的數據有限。此外,抗PF4抗體的分析似乎對給定的測定是特異性的。在這篇研究中,使用功能性HIT測定法對抗PF4抗體的ELISA結果進行了確認。這種疫苗誘導的綜合症狀患者的臨床特點是更典型的患者HIT提前看到的再暴露於肝素,包括嚴重的血小板減少症,血栓形成咄咄逼人,和瀰漫性血管內凝固病變(D.I.C)
在一般人群中接種SARS-CoV-2疫苗後,血小板減少症的風險和靜脈血栓栓塞的風險似乎並不高於基本值風險,這一發現與該綜合症狀的罕見和偶發性相符。此外,在某些患者中,接種疫苗48至72小時後出現頭痛,發燒和肌肉酸痛。這項研究中報導的事件似乎很少見 ,並且在進行進一步分析之前,很難預測誰可能受到影響。首次接種疫苗後超過5天出現症狀,反映出類似於HIT的免疫學模式。
這篇文章發現了一種新穎的機制和病理生理學基礎,可促使對治療進行仔細考慮。避免血小板輸注至關重要,因為這種治療將為進一步的抗體引發的血小板活化和凝血病變提供基礎。這些病理抗體的確切性質尚未得到鑑定,但是它們似乎屬於IgG亞型,並且如經典HIT中所見,血小板活化可以被過量的肝素完全消除。鑑定疫苗可觸發這些病理性抗體形成的機制的鑑定尚需進一步研究。對確切的病理生理機制的理解可以允許更有針對性的治療干預。
儘管尚無證據表明使用肝素會加劇這種情況,但有待進一步的數據,我們建議考慮使用非肝素類抗凝劑 (如argatroban ,danaparoid,fondaparinux或直接口服抗凝劑)進行抗凝。靜脈免疫球蛋白( IVIG )已成功用於治療“自發性”自身免疫性HIT 的患者 ,這是與該疫苗誘發的綜合症候最接近的比較,並且IVIG有望具有直接的抗體介導的毒性作用。與血漿而非白蛋白進行血漿交換也可以有效地暫時降低病理性抗體的水平,並就血纖維蛋白原減少症對凝血功能障礙提供一定的糾正。
血栓形成和明顯的消耗性凝血病的結合給與積極抗凝相關的益處和風險帶來了難題。這種困境在腦靜脈血栓形成的患者中尤為重要,他們的出血可能是災難性的,但停止抗凝治療可能同樣有害。目前尚不清楚是否有必要將積極的抗凝治療推遲至通過IVIG進行初始疾病控製或血漿置換後,但腦靜脈血栓形成患者的死亡率似乎高於預期,因此早期治療決策可能至關重要。沒有證據表明需要使用肝素替代品。但是,鑑於該綜合症候與常規HIT的相似性,可以考慮其他方法,直到獲得更多數據為止。
迄今為止,在所有報導的病例中,血小板減少症和靜脈血栓形成的綜合徵似乎都是由於接受第一劑 ChAdOx1 nCoV-19 疫苗而引發的 。儘管在收到其他針對SARS-CoV-2的疫苗後,有幾例患者的症狀與該臨床綜合徵相符的報導,但尚未確認滿足診斷標準的患者,特別是存在血小板減少症,血栓形成d-二聚體水平值高,纖維蛋白原水平值低或正常。此外,在以色列,已經向超過400萬人提供了兩劑BNT162b2疫苗(Pfizer-BioNTech),但尚未報告這種罕見綜合徵的病例。儘管自然SARS-CoV-2感染與血栓栓塞現像有關,但這些事件與本研究中描述的特定綜合徵有所不同。
Covid-19的風險仍然是全球範圍內嚴重的公共衛生考慮因素,針對SARS-CoV-2的疫苗接種提供了關鍵的保護。將不良臨床事件與疫苗接種相關聯時,存在很大的確定性風險。但是,該研究中描述的綜合症候具有臨床和實驗室特徵的結合,這是例外,並且以前從未被任何專業血液學家或神經病學家發現。正在進行的數據收集和研究可以幫助確定與肝素治療無關的病理性血小板活化抗PF4抗體的開發是否以及如何與抗SARS-CoV-2疫苗接種相關聯。
本文原文於2021年4月16日在NEJM.org上發布。
Scully M. et al. Pathologic Antibodies to Platelet Factor 4 after ChAdOx1 nCoV-19 Vaccination
Ref
Greinacher A, Thrombotic thrombocytopenia after ChAdOx1 nCov-19 vaccination. N Engl J Med. Nina H. Schultz et al. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination Scully M. Pathologic Antibodies to Platelet Factor 4 after ChAdOx1 nCoV-19 Vaccination Download PDF







你必須登入才能發表留言。