歐洲各國 AZ 疫苗接種,靜脈血栓不良反應通報沸沸揚揚,導致人心惶惶!本來歐洲的白種人就是比東方人容易發生血栓栓塞症
茲將血栓栓塞疾病(Thromboembolic diseases,TED)作個複習與各位分享
正常人體的止血機制 (Hemostasis) 是由三大因子交互作用:
血管 -Blood vessels 血小板 -Platelets 凝血因子 -Coagulation Factors 血栓形成的三大原因:Virchow’s Triads: 血管內皮受傷 Vasular abnormalities-vascular endothelial injury
血流滯留(血流力學改變) Blood stasis-alteration in blood flow 血液成份異常(血球與血漿) Blood components abnormality ,血液呈高凝固性( hypercoagulability ) 「血栓好發症」( Thrombophilia) 此一名詞:
專指無論先天或後天止血機制異常,導致血栓自發且反覆發作,且發病年齡常在40歲以前。
下列情況應考慮遺傳性血栓病: 1. < 40 歲發生靜脈栓塞
2. 反覆發作靜脈血栓或血栓性血管炎
3. 特異部位血栓(如:腸系膜靜脈或腦靜脈)
4. 使用 Coumadin 抗凝劑之初,反而發生血栓性皮膚潰爛
5. 在妊娠初期發生血栓
6. 有家族其他成員曾發生血栓者
7. 無明顯誘發原因
[註]歐洲諸國的AZ疫苗接種通報少數罕見的血栓栓塞不良事件,不知是否深入調查案例的家族史。
血栓 (Thrombus)及血栓形成(thrombosis)可分為動脈與靜脈血栓兩大類,血栓形成的機制雖有重曡,但靜脈血栓形成和動脈血栓形成的‘’起始‘’卻有差異,並且通過稍微不同的途徑進行凝塊形成。在血液滯留(stasis)或高凝狀態(hypercoagulable states)下,「靜脈血栓形成」在一般凝血過程發動之初即被激活,主要是由於受傷後-組織因子(tissue factors)的暴露;這導致凝血酶(thrombin)的形成和隨後的纖維蛋白原(fibrinogen)轉化為纖維蛋白(fibrin)。在動脈中,也有凝血酶形成,但血栓形成主要是通過血小板-粘附(adhesion)到受損血管內皮並由暴露的細胞外基質刺激來促進。可見個體對血管損傷的反應存在很大差異,其中一個重要的決定因素是個體對動脈或靜脈血栓形成的「易感性」有所不同。依病理生理學,在動脈血栓常因血管壁受損或粥様硬化,致使血小板先被活化而形成血栓,血栓成分主要為血小板、纖維蛋白、變性白血球和少量紅血球,它們共同形成網狀結構而疊附於受傷的動脈壁上,常發生於血流較快處,主要影響為阻止動脈血流動,因此可能導致組織細胞缺血或梗塞。相對地,靜脈血栓的主成分主要為紅血球、纖維蛋白及少量血小板,常出現於血流滯留的地方,尤其好犯於下肢靜脈。促成靜脈血栓的因素尙包括:血漿中凝固因子活化後不易被抑制或稀釋、某些血漿蛋白異常等,靜脈血栓與血管壁的黏附較不穏定,容易被血流沖走而形成栓子(emboli)。
一、動脈血栓 1.大部分導因於動脈血管內膜的動脈粥樣硬化(atherosclerosis )加上各種參與的危險因子包括:高齡、高血壓、糖尿病、血脂異常、吸菸、肥胖、停經後婦女、早發性冠心症家族史等。最終導致形成動脈粥樣斑塊(atheromatous plaque或稱atheroma或簡稱斑塊‘plaque’) 斑塊成分內含:脂質、巨噬細胞、鈣、膠原蛋白(collagen)與纖維素(fibrin)等物質。當血管內壁損傷,尤其在血流異常快速衝擊的斑塊撕裂處,血管內皮細胞下的膠原蛋白則暴露於血液中,血漿中的一種幫助血液凝固的蛋白稱作von Willebrand 氏因子(von Willebrand factor,vWF)立即與之結合,並導致vWF變構。隨後,變構的vWF與被活化血小板細胞膜上的複合醣蛋白(GPIb-V-IX complex)結合,使得血小板黏附於受損的血管壁上,接著啟動初級凝集(primary aggregation),而形成局部血栓(thrombus),以阻止出血。此時血小板再激活,其內在的緻密顆粒會釋放出致凝聚物質如ADP、TXA2與5-HT等,更促使膜上醣蛋白IIb/IIIa的活化,並吸引纖維蛋白原(fibrinogen )前來鍵結更多的血小板,形成不可逆的二次凝集(secondary aggregation)以鞏固血栓。血小板的變形與內在顆粒釋放可能與血小板內鈣離子濃度改變、肌動蛋白、肌球蛋白及細胞骨架等有關。倘若血栓繼續變大足以導致動脈血管內徑狹窄(stenosis),甚至動脈血管部份或完全阻塞(occlusion)影響血流,而造成所供應的組織缺氧或壞死,此時引發的疾病則包括:慢性缺血性心臟病(無症狀心肌缺氧、穏定型心絞痛)、急性冠心症(acute coronary syndrome)包括:不穩定型心絞痛及急性心肌梗塞、腦梗塞、頸動脈狹窄、周邊動脈血管疾病、腎動脈栓塞等。一旦不穩定斑塊上形成的血栓破裂,其碎片隨著血流至血管終端,造成末稍組織壞死,則稱之為栓塞(Embolism)。
2. 心血栓栓塞症( Cardioembolism)
– 心因性腦梗塞( Cadiogenic infarction) :以心房顫動( Atrial fibrillation, AF) 的心律不整最多見,若長期且慢性持續發作,則會導致左心房血液滯留或左心耳( left atrial appendage , LAA )血栓,其造成血柱栓塞( thromboemolism) 或腦梗塞之風險是正常人的 5 倍。其他心因性腦梗塞,尚有心臟有先天或後天病變者(如心瓣膜疾病),由於心臟無血流無法順利打出,部分血液容易沈積在左心室內形成栓子。
3. 遺傳代謝疾病引起的動脈血栓如:高同半胱胺酸血症 (Hyperhomocysteinemia) 乃由於參與同半胱胺酸轉硫化代謝為半胱胺酸 (Cysteine)( 此過程 B6 為其輔因子 ) 的酵素 Cytathionine β synthease , CBS 基因缺陷或同半胱胺酸再甲基化變回甲硫胺酸( Methionine)( 此過程需要活性 methyl B12 為其輔因子 ) 的甲基烯基四氫葉酸還原酶( 5,10 methylene THF Reductase )的 MTHFR C667T 基因缺陷所致。國人則以後者較常見且為雙套異接合者( TT heterozygote) 突變表現,約有 6~15% 不等。所以,當有不明原因的年輕血栓栓塞患者如早發性冠心症及缺血性腦中風,有時要檢測血中的同半胱胺酸濃度。先天遺傳的高半胱胺酸血症,甚至有 10 歲以前就發生心臟、腎臟及腦動脈栓塞,以致死亡。
@臨床上,血中同半胱胺酸濃度升高有些則是後天因素,例如:長期禁食,營養不良,維生素B6、B12或葉酸(B9)攝取不足,此時則好發於老年人。
二、靜脈血栓 主要描述在淺層或深層內的靜脈有血栓形成,若伴隨發炎反應則稱靜脈血栓炎(thrombophlebitis),血栓主要的組成分為:纖維蛋白(fibrin)、聚積在交錯的纖維蛋白內的紅血球(RBC),並有少量血小板,即便血管壁完全正常也會產生,但在血流緩慢滯留的地方更容易生成。靜脈血栓的血塊也會隨血流方向而持續延伸,尤其在血液呈高凝固性狀態(Hypercoagulability)。當然,靜脈血管受損與動脈一様,更容易形成血栓。
靜脈血栓形成的因素
一、大部分為後天原因包括:自體免疫引起的 ‘’ 抗磷脂質症候群 ‘’ 、口服避孕藥、懷孕、分娩、肥胖、年老者、長期臥床或長時間久坐(例如:長途飛行的經濟艙症候群)、創傷與骨折或外科手術(如髖、膝關節手術、腹部手術等)可致血流減緩,凝血活性增加及內皮細胞的傷害等、腎病症候群、心衰竭、惡性腫瘤(胰、胃、肺、乳房及泌尿道)等。
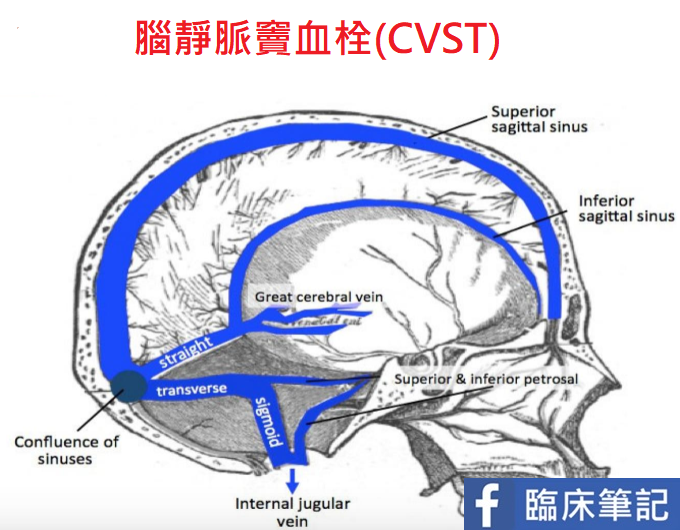
其他血液疾病引起的靜脈血栓疾病 ,例如:後天基因突變引起的陣發性夜間血紅素尿症( paroxysmal nocturnal hemoglobinuria , PNH )也常以罕見部位靜脈栓塞(肝、門脈或腦,如腦靜脈竇栓塞( Cerebral venous sinus thrombosis , CVST )為其臨床表現特徵。
抗磷脂質症候群 ( antiphospholipid syndrome , APS)
多數原發(原因不明),少數次發(自體免疫疾病:全身狼瘡症、血管炎等),乃人體產生抗磷脂自體免疫抗體(目前研究發現至少 30 種以上),臨床上常併發動、靜脈及小血管血栓及妊娠併發症包括:前 10 週內胎死腹中(但未有畸胎)或 34 週前因嚴重子癇前症( pre-eclampsia )包括: HELLP 症候群、高血壓、蛋白尿、頑固頭痛、視力模糊、肺水腫、子宮內胎兒生長遲滯、子癲症(全身性痙攣)或胎盤功能不全( placental insufficiency) 造成早產或懷孕前 10 週內發生反覆自發性流產(但胎兒無染色體異常)。
APS的實驗室檢查 :存在常見具臨床意義的中、高效價抗體包括: anticardiolipin Ab 、 anti-β2-glycoprotein Ab 或 lupus anticoagulant ,這三種抗磷脂抗體並非直接針對細胞膜的磷脂,而是針對許多與磷脂結合的血漿蛋白如: prothrombin 、 protein C 、 S 等,可見 APS 導致血栓的機制非單一因素且相當複雜。
二、少部分原因是遺傳性
1. 凝血因子抑制蛋白的缺陷
( 1 ) Protein S
( 2 ) Protein C
( 3 ) AT-III 缺乏症
( 4 ) Factor V Ledein 突變
[ 註] Factor V Ledein Mutation, 於 1993 年首先由瑞典科學家 Dr.Dahback 發現在某些家族性血栓症病人血中有此突變的第 5 凝血因子,會造成活性 C 蛋白阻抗( active protein C Resistant , APCR ),後來在歐美國家及某些地區的展開流行病學研究,發現在 ” 家族性 ” 血栓好發症中竟然佔有 10 ~ 30% 之高盛行率。
l 簡介C蛋白與S蛋白的抗凝血系統如下 :
C 蛋白( Protein C) 是由肝臟細胞製造, S 蛋白是由肝、血管內皮及骨髓巨核細胞製造,這兩種蛋白的製造過程都必須仰賴維生素 K 。當血液凝固系統産生的 thrombin 和血管內皮上的受體 thrombomodulin ( TM), 結合形成複合體,就能夠將本無活化的 C 蛋白活化。活化 C 蛋白簡稱作 APC ( active Protein C)
。 APC 在內皮細胞或血小板表面,藉 S 蛋白及第 V 凝固因子兩種輔酶的協助,能夠把已經活化的第 Va 或 VIIa 凝固因子分解破壞,達到抗凝血作用 ; 此外, APC 主要受血漿中的 Protein C 抑制劑( PCI) 及 α1-antitrypsin 抑制調節。
( 1 ) S 蛋白缺乏症
S 蛋白在血漿中 40 %為游離型,其中 60% 與補體 Cb4 結合蛋白( C4bBP )結合,只有游離型才具抗凝血活性。 S 蛋白除了為 APC 之輔酶,本身亦結合於第 Va 凝固因子而抑制 prothrobinase 的活性或直接抑制活性 Xa 凝固因子。
S 蛋白游離態的量受 C4bBP 調控抑制, C4bBP 增加則游離態 S 蛋白則減少,而 C4bBP 又受 β-glycoprotein I 和血清 amyloid P 的影響,所以 S 蛋白缺乏症的病理機制複雜而未明。
遺傳性 S 蛋白缺乏症是一種顯性遺傳,可分三型: III 型最常見,總量正常,游離態 S 蛋白減少。其次 l 型,基因缺陷導致製造減少,總量與游離均減少。第 ll 型最罕見,總量與游離態 S 蛋白均正常,這三型的 S 蛋白活性濃度則均降低。
後天性 S 蛋白缺乏的原因:肝臟疾病導致製造減少。急性炎症、腎病症候群或某些惡性腫瘤時,因 C4bBP 增加而致游離態 S 蛋白減少。但在懷孕或口服避孕藥時, S 蛋白的總量和游離態同時減少,所以是由不同的機制引起。
( 2 ) C 蛋白缺乏症
遺傳性 C 蛋白缺乏症的遺傳方式有兩大種:第一種多屬年輕人,自發性靜脈血栓,基因為單套異接合子突變。第二種發現於新生兒猛爆性紫斑症( purpura fulminans) ,多為同接合子或雙套異接合子隱性遺傳,產後數小時全身致命血栓與 DlC ,血中幾乎測不到 C 蛋白,而其父母均為無症狀之單套異接合子 𢹂 帶者。
基因表現有兩大型:第一型為基因缺陷 C 蛋白抗原和活性平行減少,最後總分泌量減少。第二型則抗原正常或微降,但 C 蛋白功能異常。
後天性 C 蛋白缺乏,常見於消耗性凝固疾病,例如: DIC 、敗血症、外科手術、急性靜脈血栓、癌症。嚴重肝病、化學藥物 L-Asparaginase 、抗凝劑 Coumadin 也能造 C 蛋白製造減少,導致血栓。
( 3 ) Antithrombin -III 缺乏症
Antithrombin (AT-III) 是由肝臟及血內細胞製造,屬 serine protease inhibitors(SERPIN) 的一員,會與絲胺酸蛋白酶( serine protease):IIa , VIIa,Xa
Xla,XIIa 等凝固因子 1:1 結合。外來肝素( Heparin )會與 AT-III 再接合,協助其抗凝作用,主要抑制 thrombin(IIa ),其次為 Xa 。
遺傳性 AT-III 缺乏症 ,為自體顯性遺傳有兩型:第 l 型為量的減少,第 ll 型則為功能活性減少。
後天性 AT-III 缺乏原因 :早產兒,老人生理性低下,消耗性凝固疾病(例如: DIC 、敗血症、子癲前症、手術前後、大量靜脈血栓等)、腎病症候群、急慢性肝病、肝素和化學物 L-Asparaginase 等。後天缺乏症,除 AT 減少外,常伴隨其他凝血蛋白減少。
( 4 ) Factor V Ledein mutation
已知佔西方白種人遺傳性血栓好發症病患最多數,約 10~30% (中國大陸與台灣沒有此基因突變),凝固因子 V 突變後會對活性 C 蛋白產生抗性( APCR ),以致突變基因胺基酸 Arg506→Gln 置換位子,就不易被 APC 切入分解,因此 Factor V Ledein 仍具輔酶功能而能促使 Xa 凝固因子的活化,導致血栓。研究顯示,西方一個有明顯家族史的靜脈血栓患者,約 50% 可找到原因,而東方國家包括大陸、台灣、日本、韓國、巴基斯坦等國家經廣泛研究均無發現此 V Leiden 胺基酸鏈上 Gln 取代 Arg506 的點突變基因。
2. 凝血因子的製造過多或抗凝血因子的製造不足
( 1 ) Prothrombin G20210A 突變導致血中的凝固因子 l l (凝血酶原, Prothrombin )濃度異常升高,再經活化的 Xa 及 Va 因子的輔助轉變成 Thrombin( 凝血酶,活化的 lla 因子)而促成血小板的活化與纖維蛋白形成,以致血栓好發症。此基因突變也是西方國家特有的,佔遺傳性血栓好症約 5~10 %,僅次於 Factor V Ledein mutation 。研究發現亞洲及非洲人罕有此突變基因,而中國大陸與台灣則尚無此突變基因。
( 2 )其他罕見的包括: Hageman ( XII )凝固因子缺乏、 XI 或 lX 凝固因子增加、血栓調節蛋白( thrombomodulin )缺乏、組織可活化因子抑制物( TAF I )增加、組織因子途徑抑制物( TFPI) 減少等
3. 纖維蛋白溶解抑制的缺陷
( 1 ) Dysfirinogenemia (異纖維蛋白原血症)
( 2 ) Plasminogen 缺乏症
( 3 ) Heparin cofactor II 缺乏
( 4 ) tissue -type plasminogen activator (tPA) 缺乏
(5)plasminogen activator inhibitor-1(PAI-1)增加
Dysfirinogenemia(異纖維蛋白原血症) 多數無症狀或僅某種程度的出血傾向,但約有 10% 病人反而發生血栓症。迄今至少有十多種不同的基因缺陷被查出。造成血栓的機制相當複雜包括:
( 1 ) fibrinogen 對 thrombin 或 plasminogen 的吸附減少
( 2 )異常的 fibrin clot 的構造
( 3 ) plasmin 無法溶解纖維凝塊
實驗室檢驗應測thrombin time和Reptilase time,同時參考血中fibrinogen 抗原濃度。
Plasminogen 缺乏症
– 纖維蛋白溶酶原(或稱漿胞素原)缺乏症
纖維蛋白溶酶原基因位於染色體6q26-6q27位置,與靜脈或動脈血柱有關。可分為hypoplasminogenemia和dysplasminogenemia兩類,一般篩檢則測plasminogen 的功能活性濃度。歐美少見,鄰近日本卻極普遍,在他們自然人口的盛行率高2~4%。台灣的研究也有相當比率的hypoplasminogenemia𢹂因者,但並不是誘發血栓的重要因子。
靜脈栓塞的部位包括 下肢深部靜脈栓塞 (Deep Vein Thrombosis) :常形成於下肢或骨盆部位深處的靜脈。本身靜脈發展有缺陷或創傷,或是凝血機能有問題,或是心臟衰竭,遠端血流不易回流,若加上長時間保持腿部於同一姿勢,特別是坐姿或蹲姿,血液容易在血管凝集而堵住靜脈回流。此時血液堆積在末端處,漸漸形成紅腫,這就是深部靜脈栓塞。下肢 DVT 如未加治療約有 20~30% 會延伸至上端(股及腸靜脈),可導致靜脈炎症候群( post-phlebitis syndrome) :乃因靜脈瓣膜損傷及血管阻塞,導致慢性下肢深部靜脈功能不全,造成長期下肢水腫,滯留性皮膚炎( stasis dermatitis )及皮膚潰瘍。 肺栓塞 (Pulmonary Embolism) :下肢靜脈內形成的血栓一旦脫落 , 會隨著血流由下腔靜脈流向右心房,最後血塊造成肺動脈阻塞 , 即形成了肺栓塞 (Pulmonary Embolism) ,未經治療死亡率高 30%~40% 。 上肢靜脈栓塞:當深部靜脈栓塞發生在上臂的靜脈如腋下及鎖骨下靜脈,稱作 Paget-Schrötter disease, 症狀為突發上臂紅、腫、熱、痛或發紺。特點:好發於年輕族群,常發生在上臂激烈運動後如鎖骨撞擊或頭臂靜脈及外頸靜脈反覆受壓迫,也可以是 thoracic outlet syndrome 的後遺症,需與因血管內導管置入導致的次發性靜脈栓塞作區分,此病有肺栓塞的嚴重併發症。 其他罕見部位包括:肝、門脈或腸系膜靜脈、腦部靜脈及腦靜脈竇等 三、動、靜脈(含小動脈或小靜脈)及微血循環組織內毛細血管(capillary)的血栓栓塞 . 後天原因包括:
( 1 )造成凝血活性增高如:細菌性內毒素、病毒、急性溶血危象、血管創傷或腐蝕、組織壞死、腫瘤細胞、血清病、彌散性血管內凝血症( DIC )等
( 2 )骨髓增殖性疾病:原發性血小板增多症、真性紅血球增多症等,除了血球過多造成全血液黏稠度升高,過多的血小板其內的緻密顆粒釋放出致血栓物質因素,如: ADP 、 5-HT 、 β-TG 、 TXA2 、鈣離子、腎上腺素等及血小板 α 顆粒釋出 PF4 及顆粒膜蛋白 (GMP-140 )在血小板表面及血漿中濃度增強,可見血小板活化也是血栓形成的重要病理機制之一
( 3 )多發性骨髓瘤及華氏巨球蛋白血症 (Waldenstrom’s macroglobulinemia , WM )
兩者因單株細胞產生過量異常的免疫球蛋白,一般 ≥4g/dL 且血清黏稠度指數 ≥4 ,才會導致血液高黏稠度症候群( Hyperviscosity syndrome) 及血流的異常。
2.自體免疫或先天遺傳的血液疾病如:栓塞性血小板減少紫斑症(Thrombotic thrombocytopenic purpura,TTP)乃由於「ADAMTS13」酶(屬一種Metalloproteases)被抑制或缺乏,以至大分子的vWF無法裂解,進而與血小板緊密結合在受傷的血管形成血栓,尤其是小動脈與微血管。
強哥( micro)
口袋筆記分享
敬請相關專家
不吝賜教指正
2021-03-20
授權轉載,來源: 林自強院長
臨床筆記社團 血栓栓塞疾病











你必須登入才能發表留言。